Hidrogena peroksido
| Hidrogena peroksido | ||||
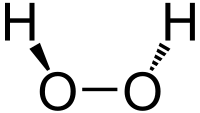 | ||||
| Plata kemia strukturo de la Hidrogena peroksido | ||||
 | ||||
| Tridimensia strukturo de la Hidrogena peroksido | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 7722-84-1 | |||
| ChemSpider kodo | 763 | |||
| PubChem-kodo | 784 | |||
| Merck Index | 14,4798 | |||
| Fizikaj proprecoj | ||||
| Aspekto | tre klarblua koloro (kiam pura), senkolora en solvaĵo kun milde akra odoro | |||
| Molmaso | 34.0147 g·mol−1 | |||
| Denseco | 1.11 g cm−3 | |||
| Fandpunkto | ||||
| Bolpunkto | ||||
| Refrakta indico | 1,4061 | |||
| Ekflama temperaturo | Nebrulema | |||
| Acideco (pKa) | 11.75 | |||
| Solvebleco | Akvo:Tute miksebla en akvo, etero k alkoholo | |||
| Mortiga dozo (LD50) |
| |||
| Sekurecaj Indikoj | ||||
| Risko | R8 R20/22 R22 R34 R37/38 | |||
| Sekureco | S17 S26 S36/37/39 S39 S45 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj | ||||
| GHS Signalvorto | Danĝera likvaĵo | |||
| GHS Damaĝo-piktogramo |   
| |||
| GHS Deklaroj pri damaĝoj | H271, H302, H314, H332, H335, H412 | |||
| GHS Deklaroj pri antaŭgardoj | P280, P305+351+338, P310 | |||
Hidrogena peroksido, iom pli mallonge hidrogenperoksido aŭ oksigena akvo (H2O2) estas kemia kombinaĵo de hidrogeno kaj oksigeno, senkolora likvaĵo, produktita plej ofte kiel akva solvaĵo. Ĝi estas uzata ĉefe por blankigo de kotono, teksaĵoj, celulozo, produktado de kemiaĵoj, pelaĵo por raketoj, por kosmetikaĵoj. Se la akva solvaĵo superas 8%, ĝi damaĝas la homan haŭton.
La kemiaĵo estis malkovrita en 1818 kaj estas plej simpla membro de la peroksidoj. Ĝi estas pli densa ol la akvo, kun kiu ĝi miksiĝas en ĉiu proporcio. La pura hidrogena peroksido frostas je −0,43 °C kaj bolas je 150,2 °C.
Oni produktas ĝin plej ofte tiel, ke oni reakciigas la oksigenon de la aero kun organikaj kemiaĵoj, ĉefe kun antrakinono aŭ izopropil-alkoholo.Oni vendas plej ofte hidrogenan peroksidon en denso de 35, 50, 70 aŭ 90% (akva solvaĵo), kiuj entenas ankaŭ stabiligilojn (plej ofte stanajn salojn kaj fosfatojn) por malpliigi la malkombiniĝon.
Je varmegigo aŭ je efiko de certaj materialoj, la hidrogena peroksido malkonstruiĝas al akvo kaj oksigeno. La procezon helpas la metalaj saloj kiel saloj de fero, kupro, mangano, nikelo kaj kromo.
Ĝi formas kun multaj kemiaĵoj kristalajn, solidajn materialojn, kiuj estas uzeblaj kiel malfortaj oksidenzoj (plej konata estas la natria perborato (NaBO2 x H2O2 x 3H2O aŭ NaBO3 x 4H2O).
La hidrogena peroksido reakcias kun certaj organikaj kemiaĵoj dum estiĝo de hidroperoksidoj aŭ peroksidoj.
La hidrogena peroksido plej ofte oksidas la aliajn materialojn, dum ĝin povas oksidi nur kelkaj kombinaĵoj (ekz. kalia permanganato).




